Ⅰ. Tăng độ nhạy của hệ phản ứng:
1. Tách RNA chất lượng cao:
Quá trình tổng hợp cDNA thành công đến từ RNA chất lượng cao.RNA chất lượng cao phải đảm bảo ít nhất là tổng số dài hơn và không chứa các chất ức chế không chứa enzym ghi, chẳng hạn như EDTA hoặc SDS.Chất lượng của RNA xác định giá trị tối đa của thông tin trình tự mà bạn có thể phiên mã sang cDNA.Phương pháp tinh sạch RNA chung là một phương pháp từng bước sử dụng isoocyanate/acidophenol.Để ngăn chặn sự ô nhiễm của RNase, RNA được tách ra từ một mẫu giàu RNase (chẳng hạn như tuyến tụy) yêu cầu lưu trữ formaldehyde để lưu trữ RNA chất lượng cao, điều này thậm chí còn cần thiết hơn để lưu trữ lâu dài.RNA chiết xuất từ gan chuột về cơ bản đã bị phân hủy sau một tuần bảo quản trong nước, trong khi RNA chiết xuất từ lá lách chuột vẫn ổn định sau ba năm bảo quản trong nước.Ngoài ra, các bản ghi lớn hơn 4kb nhạy cảm hơn với việc theo dõi sự xuống cấp của RNase so với các bản ghi nhỏ.Để tăng tính ổn định của mẫu RNA lưu trữ, RNA có thể được hòa tan trong ion methamlamin và được bảo quản ở -70°C.Thylide được sử dụng để lưu RNA không được chứa một vật thể linh tinh nào làm suy giảm RNA.RNA, có nguồn gốc từ tuyến tụy, có thể được lưu trữ trong methamlamin ít nhất một năm.Khi bạn đã sẵn sàng sử dụng RNA, bạn có thể sử dụng các phương pháp sau để kết tủa RNA: thêm NaCl vào 0,2m và thể tích ethanol gấp 4 lần, đặt nhiệt độ phòng trong 3-5 phút và ly tâm 10.000 × g trong 5 phút.
2. Sử dụng enzyme phiên mã ngược không có hoạt động RNaseH (RNaseH-):
Các chất ức chế RNase thường được thêm vào các phản ứng phiên mã ngược để tăng thời gian và năng suất tổng hợp cDNA.Chất ức chế RNase được thêm vào trong phản ứng tổng hợp chuỗi đầu tiên với sự có mặt của chất đệm và chất khử như DTT vì quá trình tổng hợp tiền cDNA làm biến tính chất ức chế, do đó giải phóng các RNase liên kết làm suy giảm RNA.Chất ức chế protein RNase chỉ ngăn chặn sự phân hủy RNA bởi RNase A, B, C và không ngăn chặn RNase trên da, vì vậy cần cẩn thận không đưa RNase từ ngón tay mặc dù đã sử dụng các chất ức chế này.
Enzyme phiên mã ngược xúc tác quá trình chuyển đổi RNA thành cDNA.Cả M-MLV và AMV đều có hoạt tính RNaseH nội sinh ngoài hoạt tính polymerase của chính chúng.Hoạt động của RNaseH cạnh tranh với hoạt động của polymerase đối với các chuỗi dị hợp tử được hình thành giữa các mẫu RNA và đoạn mồi DNA hoặc chuỗi mở rộng cDNA và làm suy giảm RNA: chuỗi RNA trong phức hợp DNA.Các mẫu RNA bị suy giảm do hoạt động của RNaseH không còn có thể được sử dụng làm chất nền hiệu quả để tổng hợp cDNA, làm giảm năng suất và thời gian tổng hợp cDNA.Do đó, việc loại bỏ hoặc giảm đáng kể hoạt động RNaseH của enzyme phiên mã ngược sẽ mang lại lợi ích lớn.
SuperScriptⅡ phiên mã ngược, phiên mã ngược MMLV của RNaseH- và phiên mã ngược thermoScript, AMV của RNaseH- mang lại nhiều cDNA có độ dài đầy đủ hơn so với MMLV và AMV.Độ nhạy của RT-PCR bị ảnh hưởng bởi lượng cDNA được tổng hợp.ThermoScript nhạy hơn nhiều so với AMV.Kích thước của các sản phẩm RT-PCR bị giới hạn bởi khả năng tổng hợp cDNA của enzyme phiên mã ngược, đặc biệt là khi nhân bản các Cdna lớn hơn.So với MMLV, SuperScripⅡ tăng đáng kể năng suất của các sản phẩm RT-PCR dài.Enzyme phiên mã ngược của RNaseH- cũng làm tăng tính bền nhiệt nên phản ứng có thể thực hiện ở nhiệt độ cao hơn bình thường 37-42℃.Trong các điều kiện tổng hợp đề xuất, mồi oligo(dT) và 10μCi [alpha-p]dCTP đã được sử dụng.Tổng sản lượng của chuỗi đầu tiên được tính bằng phương pháp kết tủa TCA.CDNA có chiều dài đầy đủ được phân tích bằng cách loại bỏ dải được sắp xếp theo kích thước và đếm trong gel agarose kiềm.
3. Tăng nhiệt độ bảo quản nhiệt của phiên mã ngược:
Nhiệt độ giữ cao hơn giúp mở cấu trúc thứ cấp của RNA và tăng hiệu suất của phản ứng.Đối với hầu hết các mẫu RNA, giữ RNA và mồi ở 65°C mà không có chất đệm hoặc muối, sau đó làm lạnh chúng nhanh chóng trên đá sẽ loại bỏ hầu hết các cấu trúc thứ cấp và cho phép các mồi liên kết.Tuy nhiên, một số mẫu vẫn có cấu trúc thứ cấp, ngay cả sau khi biến tính nhiệt.Việc khuếch đại các mẫu khó này có thể được thực hiện bằng cách sử dụng enzym sao chép ngược ThermoScript và bằng cách đặt phản ứng enzym sao chép ngược ở nhiệt độ cao hơn để cải thiện khả năng khuếch đại.Nhiệt độ giữ cao hơn cũng có thể làm tăng tính đặc hiệu, đặc biệt là khi quá trình tổng hợp cDNA được thực hiện bằng cách sử dụng đoạn mồi đặc hiệu cho gen (GSPS) (xem Chương 3).Nếu sử dụng GSP, đảm bảo rằng giá trị Tm của mồi giống với nhiệt độ giữ dự kiến.Không sử dụng mồi oligo(dT) và ngẫu nhiên trên 60℃.Các đoạn mồi ngẫu nhiên cần được giữ ở 25℃ trong 10 phút trước khi tăng lên 60℃.Ngoài việc sử dụng nhiệt độ phiên mã ngược cao hơn, tính đặc hiệu có thể được cải thiện bằng cách chuyển trực tiếp hỗn hợp RNA/mồi từ nhiệt độ biến tính 65℃ sang nhiệt độ giữ phiên mã ngược và thêm hỗn hợp phản ứng 2× đã được làm nóng trước (tổng hợp bắt đầu nhiệt cDNA).Cách tiếp cận này giúp ngăn chặn sự ghép đôi cơ sở liên phân tử xảy ra ở nhiệt độ thấp hơn.Sử dụng thiết bị PCR giúp đơn giản hóa nhiều công tắc nhiệt độ cần thiết cho RT-PCR.
Tth polymerase ổn định nhiệt hoạt động như DNA polymerase với sự có mặt của Mg2+ và RNA polymerase với sự có mặt của Mn2+.Nó có thể giữ nhiệt lên đến 65℃.Tuy nhiên, sự hiện diện của Mn2+ trong quá trình PCR làm giảm độ trung thực, điều này làm cho Tth polymerase không phù hợp để khuếch đại với độ chính xác cao, chẳng hạn như nhân bản cDNA.Ngoài ra, Tth kém hiệu quả hơn trong quá trình phiên mã ngược, điều này làm giảm độ nhạy và do một enzyme đơn lẻ có thể thực hiện phiên mã ngược và PCR, nên không thể sử dụng các phản ứng kiểm soát mà không có phiên mã ngược để phân biệt các sản phẩm khuếch đại của cDNA với các sản phẩm của DNA bộ gen bị nhiễm bẩn.
4. Phụ gia thúc đẩy phiên mã ngược:
Việc bổ sung các chất phụ gia, bao gồm glycerin và DMSO, vào phản ứng tổng hợp chuỗi đầu tiên có thể làm giảm tính ổn định của chuỗi kép axit nucleic và làm mất cấu trúc bậc hai RNA.Có thể thêm tối đa 20% glycerin hoặc 10% DMSO mà không ảnh hưởng đến hoạt động của SuperScriptⅡ hoặc MMLV.AMV cũng có thể dung nạp tới 20% glycerol mà không làm giảm hoạt tính.Để tối đa hóa độ nhạy của RT-PCR trong phản ứng sao chép ngược SuperScriptⅡ, có thể thêm 10% glycerol và cách nhiệt ở 45℃.Nếu 1/10 sản phẩm của phản ứng phiên mã ngược được thêm vào phản ứng PCR thì nồng độ glycerol trong phản ứng khuếch đại là 0,4% không đủ để ức chế phản ứng PCR.
5. Xử lý RNaseH:
Độ nhạy có thể được cải thiện bằng cách xử lý các phản ứng tổng hợp cDNA bằng RNaseH trước PCR.Đối với một số mẫu, người ta cho rằng RNA trong phản ứng tổng hợp cDNA ngăn chặn sự gắn kết của các sản phẩm được khuếch đại, trong trường hợp đó, xử lý RNaseH có thể làm tăng độ nhạy.Nói chung, xử lý RNaseH là cần thiết để khuếch đại mẫu đích cDNA có độ dài đầy đủ tương đối dài, chẳng hạn như xơ cứng củⅡ với bản sao thấp.Đối với mẫu khó này, RNaseH đã tăng cường tín hiệu được tạo bởi cDNA được tổng hợp bởi SuperScriptⅡ hoặc AMV.Đối với hầu hết các phản ứng RT-PCR, việc xử lý RNaseH là tùy chọn vì bước biến tính PCR cách nhiệt 95℃ thường thủy phân RNA từ phức hợp RNA: DNA.
6. Các phương pháp cải tiến để phát hiện một lượng nhỏ RNA:
RT-PCR đặc biệt khó khăn khi chỉ có một lượng nhỏ RNA.Việc bổ sung glycogen làm chất mang trong quá trình tách RNA giúp tăng năng suất của các mẫu nhỏ.Một glycogen không chứa RNase có thể được bổ sung cùng lúc với Trizol.Glycogen hòa tan trong nước và có thể tồn tại trong pha nước cùng với RNA để hỗ trợ quá trình kết tủa tiếp theo.Nồng độ đề nghị của glycogen không chứa RNase là 250μg/ml đối với các mẫu mô hoặc 106 tế bào nuôi cấy dưới 50mg.
Việc bổ sung BSA acetyl hóa để đảo ngược các phản ứng sao chép bằng cách sử dụng SuperScriptⅡ có thể làm tăng độ nhạy và đối với một lượng nhỏ RNA, việc giảm lượng SuperScriptⅡ và thêm 40 đơn vị chất ức chế nuclease RnaseOut có thể cải thiện mức độ phát hiện.Nếu glycogen được sử dụng trong quá trình tách RNA, thì việc bổ sung chất ức chế BSA hoặc RNase để đảo ngược phản ứng phiên mã bằng SuperScriptⅡ vẫn được khuyến nghị.
Ⅱ. Tăng độ đặc hiệu của RT-PCR
1. Tổng hợp cNDA:
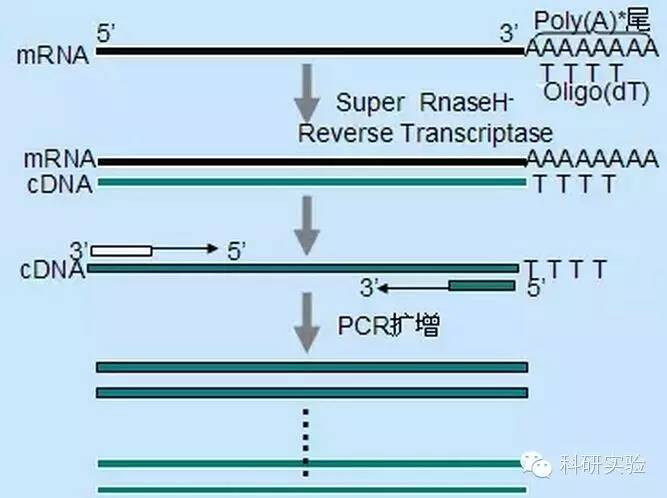
Ba phương pháp khác nhau có thể được sử dụng để bắt đầu quá trình tổng hợp cDNA chuỗi đầu tiên và tính đặc hiệu tương đối của từng phương pháp ảnh hưởng đến số lượng và loại cDNA được tổng hợp.
Phương pháp mồi ngẫu nhiên là phương pháp ít cụ thể nhất trong ba phương pháp.Các đoạn mồi được ủ tại nhiều vị trí trong suốt bản phiên mã để tạo ra cDNA ngắn, có độ dài một phần.Phương pháp này thường được sử dụng để thu được 5′ trình tự đầu cuối và cDNA từ các mẫu RNA có vùng cấu trúc thứ cấp hoặc có vị trí kết thúc mà enzyme phiên mã ngược không thể sao chép.Để thu được cDNA dài nhất, tỷ lệ đoạn mồi so với RNA trong mỗi mẫu RNA cần được xác định theo kinh nghiệm.Nồng độ ban đầu của mồi ngẫu nhiên nằm trong khoảng từ 50 đến 250ng trên hệ thống phản ứng 20μl.Vì cDNA được tổng hợp từ RNA tổng số bằng cách sử dụng đoạn mồi ngẫu nhiên chủ yếu là RNA ribosome nên poly(A)+RNA thường được chọn làm khuôn mẫu.
Khởi tạo Oligo(dT) cụ thể hơn so với mồi ngẫu nhiên.Nó lai với đuôi poly(A) được tìm thấy ở đầu 3′ của mARN trong hầu hết các tế bào nhân chuẩn.Bởi vì poly(A)+RNA chiếm khoảng 1% đến 2% tổng số RNA, nên số lượng và độ phức tạp của cDNA sẽ ít hơn nhiều so với khi sử dụng đoạn mồi ngẫu nhiên.Do tính đặc hiệu cao nên nhìn chung oligo(dT) không yêu cầu tối ưu hóa tỷ lệ RNA thành mồi và lựa chọn poly(A)+.Nên sử dụng 0,5μg oligo(dT) cho mỗi hệ thống phản ứng 20μl.oligo(dT)12-18 phù hợp với hầu hết RT-PCR.Hệ thống RT-PCR ThermoScript cung cấp oligo(dT)20 vì tính ổn định nhiệt tốt và phù hợp với nhiệt độ bảo quản cao hơn.
Đoạn mồi đặc hiệu gen (GSP) là đoạn mồi đặc hiệu tốt nhất cho bước phiên mã ngược.GSP là một oligonucleoside antisense có thể lai cụ thể với các trình tự đích RNA, thay vì ủ tất cả các Rna như mồi ngẫu nhiên hoặc oligo(dT).Các quy tắc được sử dụng để thiết kế mồi PCR cũng áp dụng cho thiết kế phản ứng sao chép ngược GSP.GSP có thể là trình tự tương tự như đoạn mồi khuếch đại được ủ ở cuối mRNA3′, hoặc GSP có thể được thiết kế để được ủ ở hạ lưu với đoạn mồi khuếch đại ngược.Đối với một số đối tượng được khuếch đại, cần thiết kế nhiều hơn một đoạn mồi antisense để RT-PCR thành công vì cấu trúc bậc hai của RNA đích có thể ngăn không cho đoạn mồi liên kết.Nên sử dụng 1pmol antisense GSP trong hệ thống phản ứng tổng hợp chuỗi đầu tiên 20μl.
2. Tăng nhiệt độ bảo quản nhiệt của phiên mã ngược:
Để tận dụng tối đa tính đặc hiệu của GSP, nên sử dụng enzyme phiên mã ngược có độ ổn định nhiệt cao.Enzyme phiên mã ngược ổn định nhiệt có thể được cách nhiệt ở nhiệt độ cao hơn để tăng tính chặt chẽ của phản ứng.Ví dụ: nếu GSP được ủ ở 55°C, thì tính đặc hiệu của GSP sẽ không được sử dụng đầy đủ nếu sao chép ngược được thực hiện ở 37°C với độ nghiêm ngặt thấp bằng AMV hoặc M-MLV.Tuy nhiên, SuperScripⅡ và ThermoScript có thể phản ứng ở 50℃ hoặc cao hơn, giúp loại bỏ các sản phẩm không đặc hiệu được tạo ra ở nhiệt độ thấp hơn.Để có độ đặc hiệu tối đa, hỗn hợp RNA/mồi có thể được chuyển trực tiếp từ nhiệt độ biến tính 65℃ sang nhiệt độ giữ phiên mã ngược với việc bổ sung hỗn hợp phản ứng 2 x đã được làm nóng trước (khởi đầu nhiệt cho quá trình tổng hợp cDNA).Điều này giúp ngăn chặn sự ghép đôi bazơ giữa các phân tử ở nhiệt độ thấp.Sử dụng thiết bị PCR giúp đơn giản hóa nhiều quá trình chuyển đổi nhiệt độ cần thiết cho RT-PCR.
3. Giảm ô nhiễm DNA bộ gen:
Một khó khăn tiềm ẩn với RT-PCR là RNA làm nhiễm bẩn DNA bộ gen.Việc sử dụng các phương pháp tách RNA tốt hơn, chẳng hạn như Thuốc thử Trizol, làm giảm sự nhiễm DNA bộ gen trong các chế phẩm RNA.Để tránh các sản phẩm được tạo ra từ DNA bộ gen, RNA có thể được xử lý bằng DnasⅠ cấp độ khuếch đại để loại bỏ DNA bị ô nhiễm trước khi phiên mã ngược.Các mẫu được giữ ở 65℃ trong 2.0mM EDTA trong 10 phút để chấm dứt quá trình phân hủy DNaseⅠ.EDTA chelate các ion magie để ngăn chặn quá trình thủy phân RNA phụ thuộc ion magie xảy ra ở nhiệt độ cao.
Để tách cDNA được khuếch đại khỏi sản phẩm khuếch đại DNA bộ gen, có thể thiết kế các đoạn mồi ủ riêng biệt với exon đã tách.Các sản phẩm PCR có nguồn gốc từ cDNA sẽ ngắn hơn các sản phẩm PCR có nguồn gốc từ DNA bộ gen bị ô nhiễm.Một thử nghiệm có kiểm soát không phiên mã ngược cũng được thực hiện trên mỗi mẫu RNA để xác định xem một đoạn nhất định là từ DNA bộ gen hay cDNA.Các sản phẩm PCR thu được trong trường hợp không có phiên mã ngược có nguồn gốc từ bộ gen.
Sản phẩm liên quan
RT-PCR dễ dàngᵀᴹTôi (Một Bước)
-Bộ kit một bước cho phép thực hiện sao chép ngược và PCR trong cùng một ống.Nó chỉ cần thêm RNA mẫu, đoạn mồi PCR cụ thể và ddH không chứa RNase2O.
-Có thể tiến hành phân tích định lượng RNA theo thời gian thực một cách nhanh chóng và chính xác.
-Bộ kit sử dụng thuốc thử phiên mã ngược Foregene độc đáo và Foregene HotStar Taq DNA Polymerase kết hợp với hệ thống phản ứng độc đáo để cải thiện hiệu quả hiệu quả khuếch đại và tính đặc hiệu của phản ứng.
-Hệ thống phản ứng được tối ưu hóa làm cho phản ứng có độ nhạy phát hiện cao hơn, ổn định nhiệt mạnh hơn và khả năng chịu đựng tốt hơn.
-Khả năng loại bỏ gDNA hiệu quả, có thể loại bỏ gDNA trong tiêu bản trong vòng 2 phút.
-Hệ thống phiên mã ngược hiệu quả, chỉ mất 15 phút để hoàn thành quá trình tổng hợp chuỗi cDNA đầu tiên.
-Các mẫu phức tạp: các mẫu có hàm lượng GC cao và cấu trúc thứ cấp phức tạp cũng có thể được đảo ngược với hiệu quả cao.
-Hệ thống phiên mã ngược có độ nhạy cao, các mẫu cấp độ pg cũng có thể nhận được cDNA chất lượng cao.
-Hệ thống phiên mã ngược có độ ổn định nhiệt cao, nhiệt độ phản ứng tối ưu là 42℃, ở 50℃ vẫn cho hiệu suất sao chép ngược tốt.
Thời gian đăng: Mar-07-2023