Là một cây mới trong phòng thí nghiệm, việc sàng lọc những cây tích cực từ một loạt cây có tỷ lệ chuyển đổi thấp không phải là một công việc tốt.Đầu tiên, DNA phải được tách ra từ một số lượng lớn từng mẫu một, sau đó các gen ngoại lai sẽ được phát hiện bằng PCR.Tuy nhiên, kết quả thường là các khoảng trống và đôi khi có một vài mục, nhưng không thể xác định liệu có phát hiện sai hay phát hiện sai..Phải chăng rất bất lực trước quá trình và kết quả thực nghiệm như vậy?Đừng lo lắng, anh trai sẽ hướng dẫn bạn cách sàng lọc cây chuyển gen dương tính một cách dễ dàng và chính xác.
Bước 1
Mồi phát hiện thiết kế
Xác định gen nội sinh và gen ngoại sinh cần phát hiện theo mẫu cần kiểm tra và chọn trình tự 100-500bp đại diện trong gen để thiết kế mồi.Các đoạn mồi tốt có thể đảm bảo độ chính xác của kết quả phát hiện và rút ngắn thời gian phát hiện (xem phụ lục về các đoạn mồi phát hiện thường được sử dụng).
Lưu ý: Các đoạn mồi được thiết kế mới cần tối ưu hóa các điều kiện phản ứng và xác minh độ chính xác, độ chính xác và giới hạn phát hiện của quá trình phát hiện trước khi phát hiện trên quy mô lớn.
Bước 2
Thiết kế giao thức thử nghiệm
Kiểm soát dương tính: Sử dụng DNA tinh khiết chứa đoạn đích làm khuôn mẫu để xác định xem hệ thống phản ứng PCR và các điều kiện có bình thường hay không.
Kiểm soát âm tính/trống: Sử dụng mẫu DNA hoặc ddH2O không chứa đoạn đích làm mẫu để phát hiện xem có nguồn nhiễm bẩn trong hệ thống PCR hay không.
Kiểm soát tham chiếu nội bộ: sử dụng tổ hợp primer/probe của gen nội sinh của mẫu cần kiểm tra để đánh giá liệu mẫu có thể được phát hiện bằng PCR hay không.
Để ý:
Các biện pháp kiểm soát dương tính, âm tính/trống và các biện pháp kiểm soát kiểm soát nội bộ nên được thiết lập cho từng thử nghiệm để đánh giá tính hợp lệ của kết quả thử nghiệm.
Chuẩn bị thí nghiệm
Trước khi sử dụng, hãy quan sát xem dung dịch có được trộn đều không.Nếu thấy có kết tủa cần hòa tan và pha theo hướng dẫn trước khi sử dụng.Hỗn hợp 2×PCR cần được pipet và trộn nhiều lần bằng micropipette trước khi sử dụng để tránh phân bố ion không đồng đều.
Để ý:
Lấy sách hướng dẫn ra và đọc kỹ, đồng thời chuẩn bị trước khi thí nghiệm theo đúng các yêu cầu của sách hướng dẫn.
Bước 4
Chuẩn bị hệ thống phản ứng PCR
Theo quy trình thí nghiệm, trộn mồi, H2O và 2×PCR trộn đều, ly tâm và phân phối chúng vào từng ống phản ứng.
Để ý:
Đối với thử nghiệm quy mô lớn hoặc dài hạn, nên sử dụng hệ thống phản ứng PCR có chứa enzyme UNG, hệ thống này có thể tránh được ô nhiễm khí dung do các sản phẩm PCR gây ra một cách hiệu quả.
Bước 5
Thêm mẫu phản ứng
Sử dụng công nghệ PCR trực tiếp, không cần quá trình tinh chế axit nucleic tẻ nhạt, khuôn mẫu có thể được chuẩn bị trong vòng 10 phút và có thể thêm hệ thống phản ứng PCR tương ứng.
Để ý:
Phương pháp phân tách có hiệu quả phát hiện tốt hơn và sản phẩm thu được có thể được sử dụng cho nhiều phản ứng phát hiện.
5.1: Lá nở ra trực tiếp
Theo kích thước của hình trong sách hướng dẫn, cắt mô lá có đường kính 2-3mm và đặt vào hệ thống phản ứng PCR.
Lưu ý: Đảm bảo rằng các mảnh lá được ngâm hoàn toàn trong dung dịch phản ứng PCR và không thêm quá nhiều mô lá.
5.2: Phương pháp tách lá
Cắt mô lá có đường kính 5-7mm cho vào ống ly tâm.Nếu bạn chọn lá già, vui lòng tránh sử dụng các mô của gân chính của lá.Dùng pipet hút 50ul Buffer P1 ly giải vào ống ly tâm để đảm bảo rằng dịch ly giải có thể ngâm hoàn toàn mô lá, đặt nó vào máy luân nhiệt hoặc bể kim loại, và ly giải ở 95°C trong 5-10 phút.
Thêm 50ul dung dịch trung hòa Buffer P2 và trộn đều.Lysate thu được có thể được sử dụng làm khuôn và thêm vào hệ thống phản ứng PCR.
Lưu ý: Lượng mẫu nằm trong khoảng 5-10% của hệ thống PCR và không được vượt quá 20% (ví dụ: trong hệ thống PCR 20μl, thêm 1-2μl dung dịch ly giải, không quá 4μl).
Bước 6
phản ứng PCR
Sau khi ly tâm ống phản ứng PCR, nó được đặt trong dụng cụ PCR để khuếch đại.
Để ý:
Phản ứng sử dụng khuôn mẫu không tinh khiết để khuếch đại, do đó số chu kỳ khuếch đại nhiều hơn 5-10 chu kỳ so với khi sử dụng khuôn mẫu DNA tinh khiết.
Bước 7
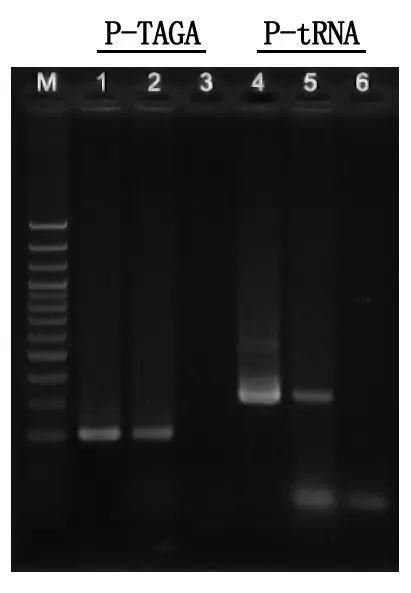
Phát hiện điện di và phân tích kết quả
M: Thang DNA 100bp
1\4: Phương pháp tinh sạch DNA
2\5: Phương pháp PCR trực tiếp
3\6: Điều khiển trống
QC:
Kết quả thử nghiệm của các bộ kiểm soát khác nhau trong thử nghiệm phải đáp ứng các điều kiện sau.Mặt khác, nguyên nhân của sự cố phải được phân tích và thử nghiệm phải được thực hiện lại sau khi sự cố được loại bỏ.
Bảng 1. Kết quả xét nghiệm thông thường của các nhóm đối chứng khác nhau
*Khi plasmid được sử dụng làm đối chứng dương tính, kết quả xét nghiệm gen nội sinh có thể âm tính
Nhận định kết quả:
A. Kết quả xét nghiệm gen nội sinh của mẫu là âm tính, cho thấy DNA phù hợp để phát hiện PCR thông thường không thể được chiết xuất từ mẫu hoặc DNA được chiết xuất có chứa chất ức chế phản ứng PCR và nên chiết xuất lại DNA.
B. Kết quả xét nghiệm gen nội sinh của mẫu là dương tính và kết quả xét nghiệm gen ngoại sinh là âm tính, cho thấy DNA phù hợp để phát hiện PCR thông thường được chiết xuất từ mẫu và có thể phán đoán rằng gen XXX không được phát hiện trong mẫu.
C. Kết quả xét nghiệm gen nội sinh của mẫu dương tính và kết quả xét nghiệm gen ngoại sinh dương tính, cho thấy DNA phù hợp để phát hiện PCR thông thường đã được chiết xuất từ mẫu và DNA mẫu chứa gen XXX.Các thí nghiệm xác nhận có thể được thực hiện thêm.
Bước 8
Mồi phát hiện thiết kế
Sau thí nghiệm dùng dung dịch natri hypoclorit 2% và dung dịch etanol 70% lau khu vực thí nghiệm để tránh ô nhiễm môi trường。
Thời gian đăng: 08-09-2021